近日,我院程冲研究员团队联合德国柏林自由大学Rainer Haag教授等研究人员在高分子基病毒抑制剂领域取得的重要研究成果,相关研究已经在国际顶级期刊Science Advances在线发表(Heteromultivalent topology-matched nanostructures as potent and broad-spectrum influenza A virus inhibitors)。该合作团队报道了一种具有拓扑匹配结构的新型多价高分子纳米制剂,其可实现高效广谱的抑制流感病毒。相对于传统的抑制剂,该多价纳米制剂对病毒的抑制浓度可低至32.4±13.7 μg/mL,并可以减少99.99%的病毒传播。由于在新冠病毒也具有类似的结构,研究团队预期该研究结果将有助于新冠病毒高分子抑制剂的研发。论文的第一作者为我院优秀硕士毕业生聂川雄,现为柏林自由大学博士后。

传染性病毒一直以来是公共卫生的一大公敌。2019年底爆发的新型冠状病毒(SARS-CoV-2)快速席卷全球,目前已造成愈8400万人感染,180万人死亡。除SARS-CoV-2这种新型病毒之外,在人们身边还有非常多的具有高感染性和致病性的病毒,其中最为常见的是甲型流感病毒,比如1934年的‘西班牙流感’和2009年始于美国的‘甲型H1N1流感’。由于流感病毒的多样性和高变异性,开发和设计可高效阻断病毒与其受体相互作用的抗病毒抑制剂可能是防止不同类型病毒感染的通用新策略。然而,设计具有抗病毒感染能力的高分子病毒抑制剂是一项艰巨但极具意义的研究。
从形貌学上来看,流感病毒的病毒颗粒是一个约100 nm的纳米颗粒,在其表面有两个非常重要的蛋白:血液凝集素(HA)和神经氨酸酶(NA)。HA和唾液酸受体结合从而介导病毒入侵宿主细胞,NA可以切断HA和唾液酸受体的结合介导病毒释放。针对这两个蛋白在流感病毒表面形成的一个粗糙的纳米表面,该研究团队在前期的研究中开发出具有刺状结构的高分子基纳米抑制剂,可极大的提高病毒-抑制剂的相互作用(Nano Letters 2020, 20, 5367; Angew. Chem. Int. Ed. 2020, 59, 15532)。
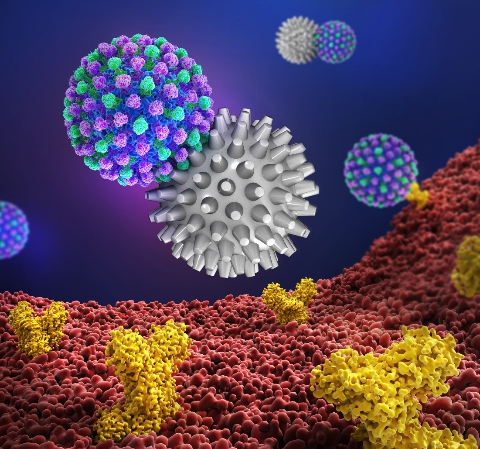
图1. 刺状纳米抑制剂高效中和流感病毒。
近年来,除了刺状纳米结构,开发具有其他拓扑匹配结构的多价高分子纳米抑制剂被认为将进一步增加抑制剂对病毒的结合和中和效率。在本工作中,研究团队基于人体红细胞膜作为基材,开发出具有唾液酸与zanamivir双重特异性结合能力的异质多价结构。全内反射荧光显微镜的观察显示zanamivir的引入显著提高了红细胞膜对流感病毒的结合能力,流感病毒附着在异质多价结构表面的比率比同质多价表面高出三倍。
在此基础上,通过将该高分子异质多价结构与拓扑结构相结合,将其均匀包覆在碗状纳米颗粒表面,构建出具有与流感病毒形貌匹配的异质多价拓扑纳米结构。由于流感病毒粒子大多是一个直径约100 nm的纳米球体,在合成中,选择了一个约120 nm的凹形碗状结构来匹配及增加多价键相互作用。该碗状结构NB-RBCm对病毒的IC50抑制值约为球型结构NS-RBCm的4倍。通过模型计算,在凸型抑制剂(NS)的情况下,病毒粒子可以通过爬行和滑动释放,而凹形碗状结构强的空间屏蔽和小的边缘距离使得多价作用更加稳定,从而表现出比凸型更好的病毒抑制能力。
本研究首次证实了具有拓扑匹配结构的新型异质多价高分子纳米制剂可高效广谱(99.99%)的抑制流感等致命病毒。由于新冠病毒与流感病毒在结构、感染症状及感染周期上有许多相似之处,研究团队认为通过设计具有靶向S蛋白不同结构域的多价键纳米结构也将为制备高效的新冠病毒高分子抑制剂提供全新的研发策略。
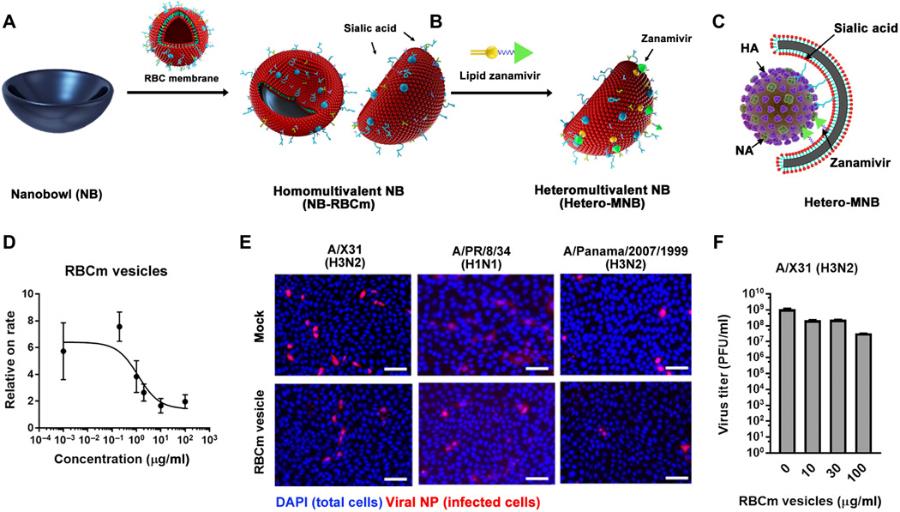
图2. 设计具有拓扑匹配结构的新型多价高分子纳米制剂及红细胞膜对流感病毒的抑制效率。
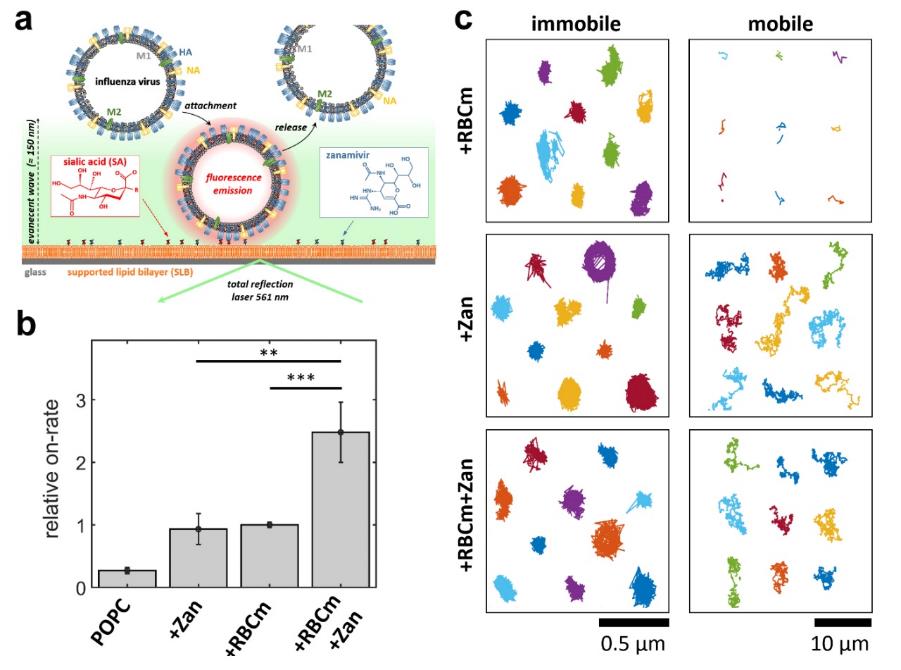
图3. 基于全内反射荧光法(TIRF)观察的改性红细胞膜与病毒颗粒之间的多价键相互作用。
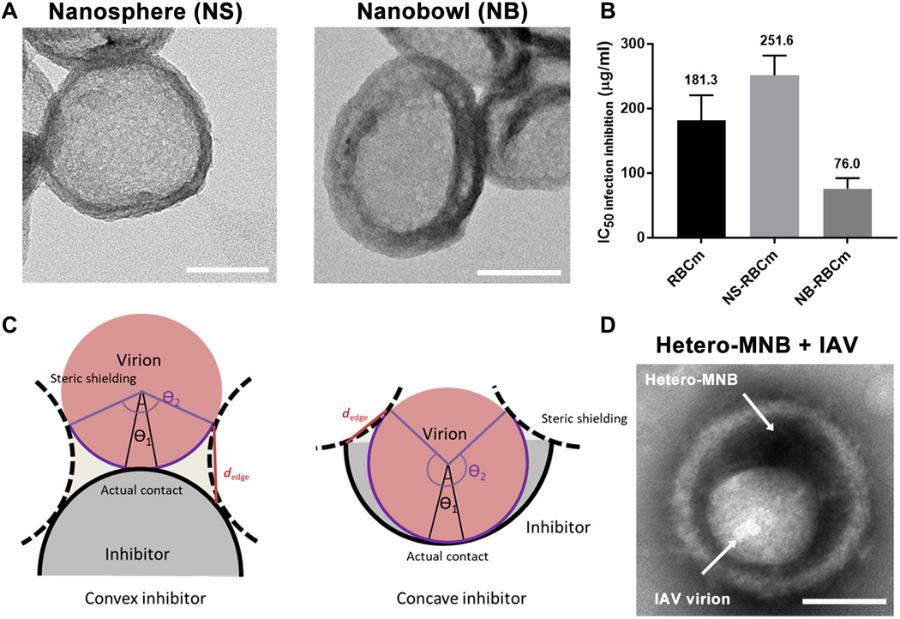
图4. 通过形貌匹配原则增加高分子碗状纳米抑制剂与病毒颗粒的相互作用。
程冲研究员长期致力于开发面向临床重大疾病治疗的先进高分子生物医用材料及生物仿生催化制剂,近期围绕抗耐药菌、抗病毒、抗肿瘤、抗关节炎、干细胞分化诱导及组织器官再生等领域开展了一系列富有成效的研究工作,目前以第一和通讯作者在Chem. Rev.、Science Adv.、Adv. Mater.(5篇)、Nano Today、Nano Lett.(2篇)、Adv. Funct. Mater.(3篇)、Small、Nano-Micro Lett.等国内外一流期刊上发表论文65篇,目前共发表论文100余篇,总引用5000余次,H-index为40。在申及授权中国发明专利9项,欧洲专利1项及PCT专利2项,并参编英文著作1章,担任Advanced Fiber Materials等多个国际期刊的杂志(青年)编委。
论文链接:https://advances.sciencemag.org/content/7/1/eabd3803
供稿:程冲
核发:杨伟
编辑:余蓉